Un quadro problematico
Secondo una studio del 2001 [1], il 9,4% delle donne sopra i quarant'anni (perciò già da molto giovani) e l'11,8% degli uomini sopra i sessanta sono affetti da osteoporosi, le percentuali aumentano notevolmente qualora si parli di osteopenia (per le stesse fasce di popolazione si arriva infatti al 47,2% per le donne e 46,1% per gli uomini), ed in maniera ancora più evidente in proporzione all'età del campione di pazienti considerato. Il dato evidenzia una problematica rilevante, peraltro di non semplice soluzione.
Le linee guida [2,3] basano l'approccio a questa malattia prevalentemente sull'assunzione di calcio e vitamina D, estrogeni, bifosfonati (per osteoporosi indotta da glucocorticoidi), ma si concentrano fondamentalmente sulla prevenzione in età giovanile. Non è raro, purtroppo, che queste strategie terapeutiche non ottengano i risultati sperati, principalmente a causa di situazioni endocrino-metaboliche che di fatto ne limitano l'applicabilità, addirittura arrivando ad attivare una serie di effetti collaterali dovuti alle stesse terapie.
Per individuare la strategia terapeutica più efficace è anzitutto necessario comprendere quali siano le ragioni prevalenti nella determinazione della demineralizzazione ossea in atto, considerato che posso essere diverse e non risolvibili mediante un unica terapia.
Comprendere il metabolismo osseo
La struttura ossea [4-7] è composta da tessuto connettivo fortemente mineralizzato (la sostanza minerale costituisce circa il 70% delle ossa), attraversato dai necessari dotti sanguigni e linfatici. Della sostanza organica presente nell'osso, costituita in gran parte da collagene tipo 1, fanno parte anche le cellule ossee, coinvolte nella varie fasi del metabolismo osseo; queste cellule si suddividono in due fondamentali categorie:

Figura 1: principali interazioni coinvolte nel metabolismo osseo
Queste cellule non agiscono indipendentemente, ma spostandosi in gruppi detti BMU (Basic Multicellular Unit, unità basilare multicellulare) composte sostanzialmente da un fronte di osteoclasti che viene di fatto seguito da un certo numero di osteoblasti. Il prevalere dell'attività di una delle due tipologie di queste cellule è il principale fattore in grado di differenziare le fasi di crescita, mantenimento (rimodellamento) o demineralizzazione dello scheletro. Il massimo livello di densità ossea è solitamente raggiunto intorno ai vent'anni d'età, mentre dopo i trenta inizia di norma la sua diminuzione.
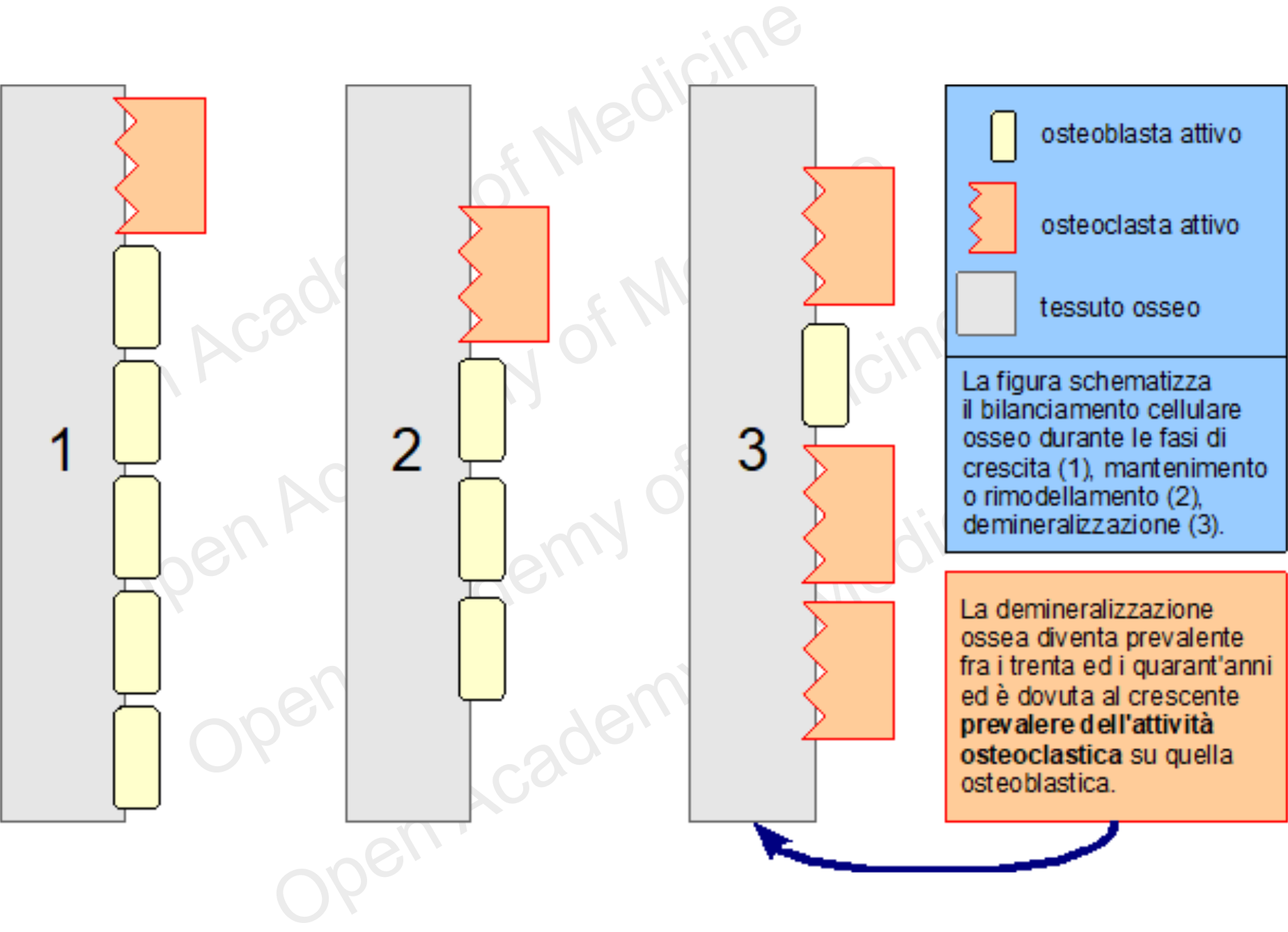
Figura 2: schematizzazione del bilanciamento cellulare osseo
L'equilibrio di questi processi antagonisti dipende da più fattori in grado di influenzare il tempo di apoptosi cellulare (generalmente la vita degli osteoclasti è molto più corta di quella degli osteoblasti) o la genesi di osteoblasti ed osteoclasti.
Durante la loro attività di rimodellamento osseo, gli osteoblasti possono restare intrappolati nella matrice da loro stessi composta, evolvendosi in osteociti: cellule che, attraverso lunghe propaggini delle citoplasmatiche, formano una rete di scambio che attraversa il tessuto osseo, in grado di comunicare sia con il midollo che con le BMU (ad esempio al fine di stimolare il rimodellamento di un particolare frammento osseo).
Il tessuto osseo non soggetto a rimodellamento è generalmente protetto da un microstrato di collagene arginato da uno strato di cellule di rivestimento osseo (dette lining-cells, cellule derivate da osteblasti disattivati): questo materiale organico impedisce agli osteoclasti di aderire alla superficie mineralizzata e viene eventualmente rimosso dalle lining cells che, tramite la mediazione degli osteociti, possono essere stimolate alla produzione di collagenasi (che degrada il collagene tipo 1 e 2).
Variazioni della densità ossea
La diminuzione della densità ossea è un processo che inizia tra i trenta ed i quarant'anni sia negli uomini che nelle donne, a causa di una sproporzione crescente nei processi coinvolti nella rigenerazione del tessuto osseo caratterizzata da un'aumentata attività osteoclastica. Nella maggior parte dei casi questo fenomeno non è legato ad una scarsa assunzione di calcio, ma piuttosto ad altri fattori, prevalentemente endocrini e metabolici, in grado di influenzare l'attività di osteoblasti ed osteoclasti. È comunque il prevalere dell'azione degli osteoclasti su quella degli osteoblasti a determinare la graduale demineralizzazione (e la conseguente fragilità) ossea.
Fattori endocrini
Tra i fattori più comunemente coinvolti nello sbilanciamento tra l'azione di osteoclasti ed osteoblasti, oltre alla carenza di ormoni sessuali (estrogeni, testosterone), si riscontra l'eccesso cronico di glucocorticoidi [8-15] (sia endogeni che esogeni; BIA-ACC - Flat Low/High HPA axis index).

Figura 4: glucocorticoidi e metabolismo osseo (BIA-ACC - Flat Low/High HPA axis index)
Sono provati gli effetti di tale eccesso sul metabolismo osseo, attraverso meccanismi sia diretti sulle cellule ossee, che mediati da interazioni a locali e sistemiche con ormoni, fattori di crescita e citochine.
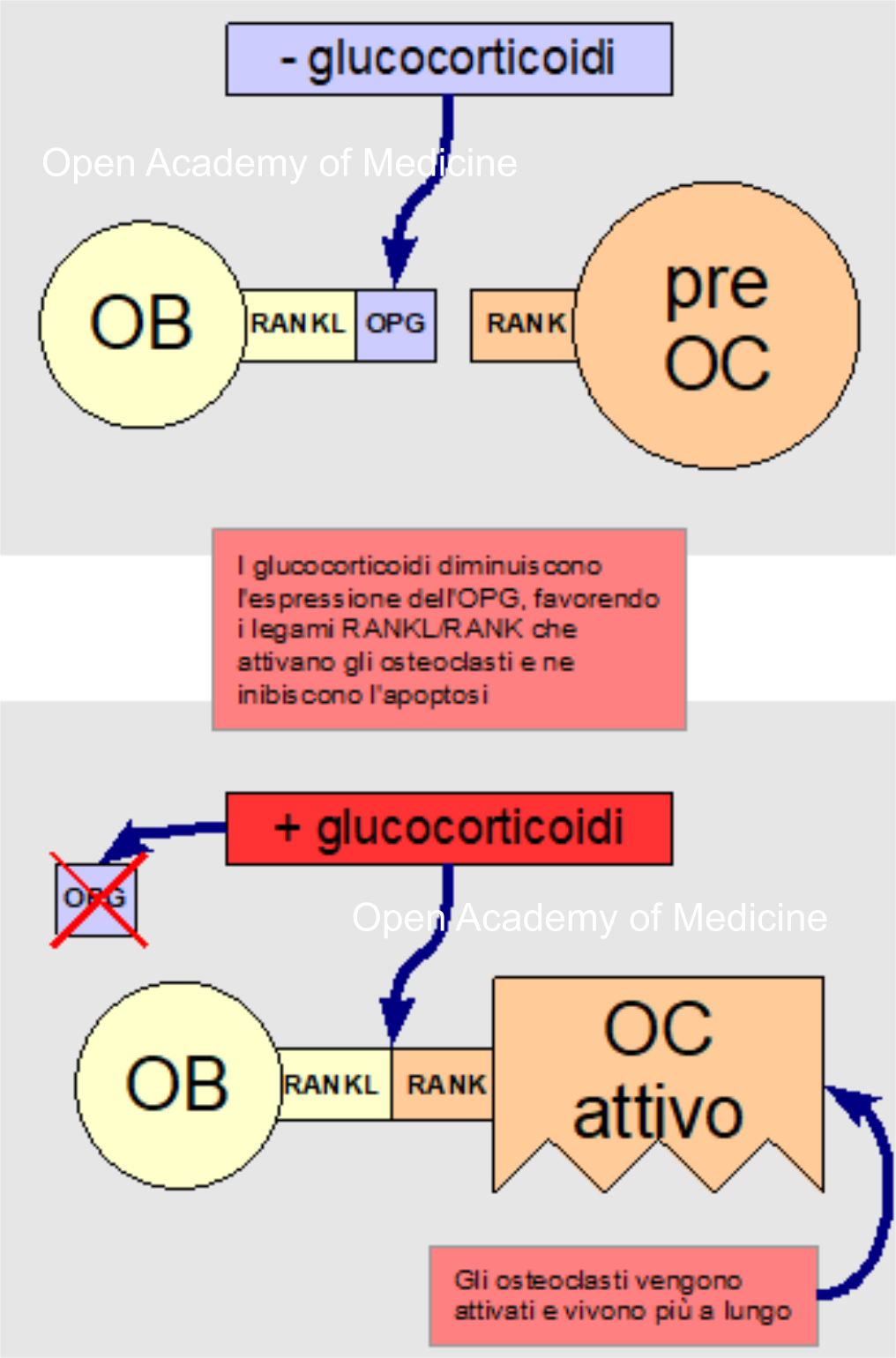
Figura 5: glucocorticoidi e legami RANKL/OPG/RANK
A livello endocrino, i glucocorticoidi riducono l'assorbimento intestinale di calcio, aumentandone nel contempo l'eliminazione a livello renale, provocando conseguentemente ipocalcemia. Questa condizione si associa ad un'aumentata attivazione degli osteoclasti e pertanto all'aumento del riassorbimento osseo (la ricerca dovrà chiarire se a causa di iperparatiroidismo indotto dai glucocorticoidi o di aumentata sensibilità al PTH degli osteblasti, che reagirebbero a questo ormone attivando gli ostoclasti). I glucocorticoidi inibiscono inoltre la secrezione di GH e la sintesi degli ormoni sessuali, mentre l'aumento di glucocorticoidi si associa ad un'aumentata espressione di collagenasi, con effetti negativi sulla materia organica ossea (vedi per approfondimento asse HPA: Insonnia, disturbi del tono dell'umore, ansia, malinconia, depressione, MUS, attacchi di panico).
I glucocorticoidi producono anche effetti diretti sulle cellule ossee attraverso il sistema di citochine RANKL/OPG [7,16], aumentando l'espressione delle prime e diminuendo quella delle seconde, e favorendo in tal modo il legame tra le citochine RANKL (espressa sulle membrane degli osteoblasti) con i recettori RANK (sulle membrane dei progenitori degli osteoclasti); tale legame stimola la differenziazione e l'attivazione degli osteoclasti e ne inibisce l'apoptosi (morte cellulare programmata).
L'aumento di glucocorticoidi inoltre, inibisce il fattore di differenziazione osteoblastica, riducendo l'attività di rigenerazione ossea, ed aumenta inoltre l'apoptosi di osteoblasti ed osteociti. Anche l'apoptosi degli osteociti ha un ruolo fondamentale nella fragilità ossea, essendo gli osteociti, come già visto, coinvolti nell'attivazione delle BMU e dei processi di rimodellamento osseo.
Gli effetti descritti sono riscontrabili sia a causa di eccessi di glucocorticoidi esogeni [9,14] (e vanno pertanto tenuti in particolare considerazione per pazienti che assumano glucocorticoidi a fini terapeutici), che endogeni. Accennando brevemente ai fattori coinvolti nell'eccesso cronico di cortisolo e nello sfasamento del relativo ritmo circadiano (BIA-ACC - Flat Low/High HPA axis index), si ricordano le presenza di processi infiammatori cronici, lo stress cronico dell'asse HPA e la cattiva nutrizione [26-29] .
È provata l'efficacia degli acidi grassi omega-3 ad alta titolazione di EPA+DHA nell'intento di ridurre l'espressione delle citochine RANKL e di aumentare le OPG [17-21] quindi nel diminuire l'attivazione degli osteoclasti; l'assunzione di omega-3 ad alta titolazione di EPA+DHA si associa inoltre ad un abbassamento della concentrazione di citochine proinfiammatorie (ad esempio IL-6 e TNF-α), pertanto gli effetti di questi acidi grassi concorrono in più direzioni a ridurre l'assorbimento osseo. Recenti studi [22,23] hanno inoltre segnalato come alcuni flavonoidi del luppolo (Humulus Lupulus L.), in particolare lo xantohumolo, siano in grado di interagire selettivamente con i recettori degli estrogeni e di esercitare un'attività simile a quella degli estrogeni sul metabolismo osseo (riducendo quindi la demineralizzazione), senza produrre gli effetti collaterali delle terapie ormonali (più pubblicazioni segnalano l'aumento di rischio di cancro al seno ed all'utero), evidenziando per di più un effetto protettivo nei confronti di tali problematiche (vedi supplementazione ad alta titolazione di EPA+DHA+Humulus Lupulus L.).
Fattori metabolici

Figura 6: acidosi e metabolismo osseo (vedi supplementazione con sistemi tampone)
Il rimodellamento osseo non solo è funzionale alla rigenerazione del tessuto ed all'adeguamento della struttura scheletrica alle sollecitazioni meccaniche a cui sia sottoposta, è infatti un processo essenziale all'omeostasi del calcio, trovandosi nel tessuto osseo la principale riserva di calcio dell'organismo. L'equilibrio con il calcio ione libero nel plasma (ed una sua eventuale deficienza) non è tuttavia l'aspetto prevalente da considerare sotto questo punto di vista: è infatti noto come il tessuto osseo rivesta un ruolo fondamentale nel bilanciamento del pH corporeo, costituendo di per sé un sistema tampone contro l'acidosi [24,25] . La decalcificazione prodotta al fine di preservare il pH corporeo può ovviamente portare all'aumento della fragilità ossea e ad ipercalcemia.
In un'ottica terapeutica, pertanto, al fine di far fronte ad una situazione simile, risulta fondamentale l'assunzione di un'opportuna supplementazione con sistemi tampone fosfato e bicarbonato (vedi supplementazione con sistemi tampone): il ripristino del pH diviene infatti prioritario [30-31] rispetto al reintegro di calcio, considerando che questo potrebbe già presentare concentrazioni plasmatiche eccessive proprio a causa della demineralizzazione ossea in atto.
Perché strutturare la terapia?
Qualora il tessuto osseo sia soggetto a demineralizzazione per uno o più dei motivi discussi, sarà necessario trattare il paziente in modo da correggere tale tendenza prima di valutare la classica integrazione di calcio e vitamina D (che potrebbe non essere necessaria), in quanto l'eccesso di queste componenti, privato delle condizioni sistemiche atte ad un recupero del tessuto osseo, porterebbero con facilità ad effetti collaterali quali calcificazioni dei tessuti molli, o calcolosi renale, e non sarebbero comunque in grado di arginare la perdita di minerale osseo in atto.

Figura 7: effetti collaterali di una terapia che non affronti gli aspetti endocrini e metabolici
Autori: Dario Boschiero - Data: 14/12/2020
Attenzione: l'utilizzo dei contenuti è libero per il solo ed esclusivo utilizzo di studio personale, la fruizione è regolata dalla L. n. 633/1941 e ss.mm.ii. e dalle norme vigenti in materia di tutela del diritto d'autore e dei brevetti. È vietato qualsiasi utilizzo a fini commerciali e di profitto.
Bibliografia